【案例1】在某试剂厂质控室,审核员看到有一台从德国进口的全自动生化分析仪。审核员问质控室主任:“这台仪器你们如何校准?”
主任回答:“技术监督局的人说他们不能校准,还想派人到我们这里来学习如何使用呢。”
审核员说:“难道你们自己就没办法校准了吗?”
主任想了一会儿说:“我们每年参加卫生部临床检验中心的比对,他们提供标准物,我们进行测试,然后把我们的结果与靶值比较,结果都很满意,这算不算校准呢?”并出示了今年3月份比对结果的结论。
审核员:“这当然是校准。你们公司有几台这样的仪器?”
主任:“在开发部还有一台。”
审核员:“他们也参加比对吗?”
主任:“他们没有参加比对。”
审核员:“你们与他们进行过比对吗?”
主任:“正式的比对试验没做过。”
案例分析:质控室的生化自动分析仪与卫生部临床检验中心进行比对,这种校准方法是可行的。由临检中心发放标准物到各实验室,大家独立测量,评估各实验室测量值与所设靶值之间的偏差。这样可以考察各实验室的设备、人员、环境等各方面的因素对检测的影响。这种校准的方法称为“MAP”(“计量保证方案”)。
在本例中,质控室还应编制校准规程,按照规程与开发部的自动分析仪进行比对,这样就完成了对检测仪器的校准工作。质控室没有做这方面的工作,违反了标准“7.6监视和测量装置的控制”的“a)……当不存在上述标准时,应记录校准或检定的依据;”
【案例2】审核员在某医疗器械生产车间,看到产品的作业文件是英文。
审核员问车间主任:“你们懂得英文吗?”
主任:“我们不懂,这是客户来的资料。但这种产品我们很熟,看数字也能猜到指的是什么项目”
案例分析:本案违反了标准“4.2.4文件发布前得到评审与批准,以确保文件是充分的与适宜的”的规定。
【案例3】在某药厂仓库,审核员要求查阅7~10月份的进货检验记录。审核时发现,7、8两个月的药材含水量记录多是6.2%、7.5%、6.3%等不同的具体数字,检验员说这些都是实测的结果;而9月份以后的记录均为8%
审核员问:“为什么这些结果数字都一样?”
检验员说:“用仪器检验太麻烦,对于粉状的原料还较容易,把含水量测定仪的探针插人麻袋就行了,但是对于大块的原料,我们还得烘干、用天平称量,很费事。我们检验员凭经验用手一捏就知道含水量是否合格,所以就都填写8%了。而且含水量对产品质量影响不太大。”
审核员看到《进货检验规程》中规定对于进货原材料应使用仪器进行含水量的检验。
案例分析:本案是检验的有章不循,违反了标准“8.2.4产品的监视和测量”的“这种监视和测量应依据所策划的安排,……”
【案例4】公司生产系列高压硅堆,据总经理说他们生产的都是定型产品,因此没有设计开发的工作。
审核员在现场审核时看到一位技术员正在对某种新型高压硅堆进行测试,审核员问:“这是定型产品吗?”
技术员回答:“这是我们刚刚由外单位引进的新产品,目前正在工艺调整阶段。”
审核员问:“对于工艺的转化你们做了哪些工作?”
技术员答:“由于该类型产品我们从来没有生产过,而且还要增加一些新的设备,加上没有这方面的经验,我们在工艺科的指导下已反复做了十几遍试验了,估计最近就可取得成功。”
审核员要求查看这方面有关的技术资料,例如产品的立项、策划、工艺转化的记录等等,
技术员说:“我们没有把设计开发纳人质量管理体系,因此这方面的记录很不规范。”
审核员问公司经理:“为什么不把设计开发纳人质量管理体系控制?”
经理回答:“听说标准对技术开发的控制要求很麻烦,因此我们就不纳入管理了。”
该公司申请认证的范围是“高压硅堆系列产品的制造、销售”。
案例分析:对引进工艺的消化、吸收、转化也存在着设计开发的工作。公司既然申请认证的范围覆盖了高压硅堆系列产品,就应把与此系列产品有关的各个产品实现过程都纳入质量管理体系的控制范围。
本案违反了标准“1.2应用”的“当本标准的任何要求因组织及其产品的特点而不适用时,可以考虑对其进行删减。”所规定的删减条件。
【案例5】在某建筑装饰构件生产厂,其产品是由水泥、沙子和各种添加物按配比搅拌均匀后,在模型中放人玻璃纤维布及加强筋,然后填入混合料而成。审核员看到在车间四周有许多已由模型中脱模的产品靠墙而立。
审核员问检验员:“这些产品检验了没有?”
检验员说:“我们是百分之百检验,检验完一件就拉到外面场地去,因此这些是没有完成检验的产品。”
审核员问:“有没有可能出现已经检验完而来不及拉出去的产品?”
检验员:“有时候也可能有,但我们都能记住哪些是检验完的。”
审核员看到,产品摆放比较混乱,因为由模型中脱模出来的产品时间不同,有快有慢,因此到处都可能有已经完成的产品,但是产品上没有任何检验状态的标记。
案例分析:这是产品的检验状态标识不明的问题。即使检验员能记住产品的检验状态,但是由于现场到处都摆放着产品,难免没有混淆的时候。
本案违反了标准“7.5.3标识和可追溯性”的“组织应针对监视和测量要求识别产品的状态。”
【案例6】在《质管部工作手册》上规定:“定期召开公司的质量例会,对各部门质量情况进行讨论交流……”。
审核员问质管部部长:“你们多长时间召开一次质量例会?”
质管部长回答:“一般是半个月开一次。”
审核员查看最近半年来的质量例会记录时发现,有两次会议时间间隔超过一个月。质管部长说:“那两次是因为工厂正在赶任务,大家都很忙,因此时间就拖下来了。”
案例分析:定期召开质量例会的方法是一种对质量管理体系进行监视和测量的有效手段,因此公司应该坚持按照规定定期召开质量例会。本案违反了《质管部工作手册》的规定,违反了标准“8.2.3过程的监视和测量”的规定。
【案例7】审核组在对公司领导进行审核时,要求管理者代表对于在质量管理体系中自身职责履行情况进行介绍。管理者代表说,我主要是保证作用,具体工作都由质管部组织进行,有什么不能解决的问题再找我。
该公司的管理者代表是由生产副厂长兼任。
案例分析:管理者代表的职责在标准中已有明确的规定。但是在许多企业中,往往把质量管理体系的工作都推到下面具体的工作人员身上,总经理或管理者代表很少过问体系的运行状况。该例中管理者代表由生产副厂长兼任,也不太合适,因为生产与质量是一对既对立又统一的整体,生产者兼管质量缺少公正性。但对于小型企业,由于人员少,可能只好如此了。
本案违反了标准“5.5.2管理者代表”的规定。
【案例8】在建筑工地,工人正在进行钢筋绑扎。工地监理发现某部位基础钢筋直径偏细,于是要求停工,向设计院询问。设计院经核对后承认出现了计算错误,并说因为是用的计算机辅助设计软件设计的,设计人一般情况下不再核对计算,可能是计算机软件用错了。
案例分析:很显然,设计院对于设计输出的结果没有进行验证。违反了标准“7.3.5设计和开发验证”的规定。
【案例9】在供应部审核员看到《供方评定记录表》
审核员问:“质管部和财务部为什么有保留?”
供应部长说:“质管部发现有两次进货焊条药皮有脱落,财务部则认为价格太高。”
审核员要求查看其他有关的资料,供应部长说:“每个供方我们都是这样评价的,除了供方自己提供的资质证明材料外,没有其他资料了。”
审核员问:“对于供方是否有重新评价的规定?”
供应部长回答说:“没有。一般我们在开始时评价一次,除非供方的质量太差,否则以后不会有太大的变动。”
案例分析:按照标准的要求,对于供方还应有重新评价的措施,不能只做一次评价就一劳永逸了。重新评价的方法,可以采用对各供方在一段时间内的进货合格率进行统计分析,或根据需要过一段时间对供方进行一次复评确认等方式进行。
本案违反了标准“7.4.1采购过程”的规定。
【案例10】某化工厂工艺文件规定,对于110”产品的工艺监控,应每小时记录一次生产流程中管道的温度、压力和流量。审核员在检查8月份的监控记录时发现,记录的参数是每3小时记录一次。生产组长说:“由于工艺十分稳定,没必要每小时记录一次。”
案例分析:这是生产中对产品监视的有章不循,违反了标准的“8.2.4产品的监视和测量”中的规定。
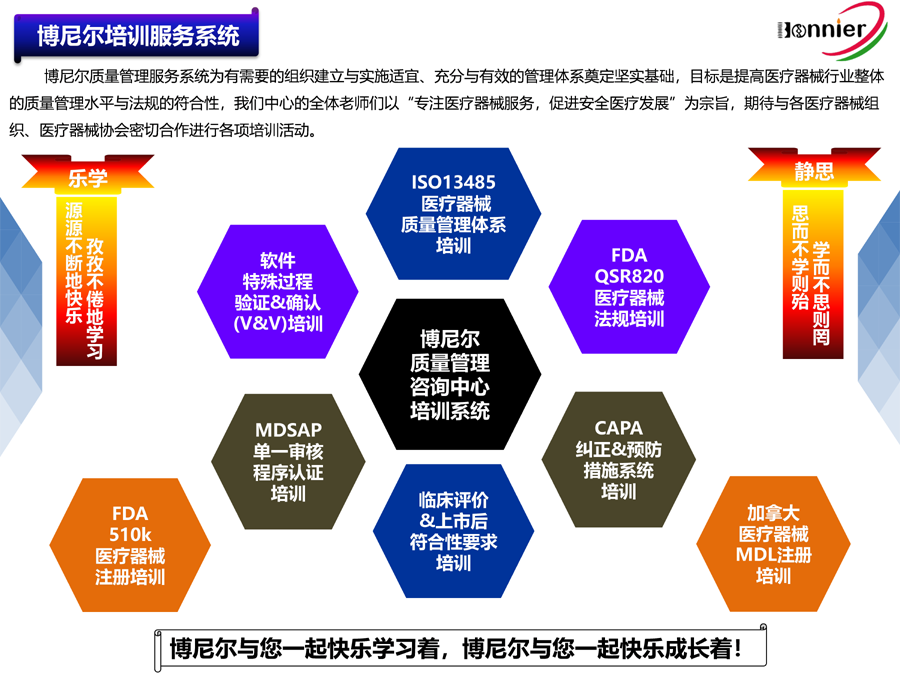
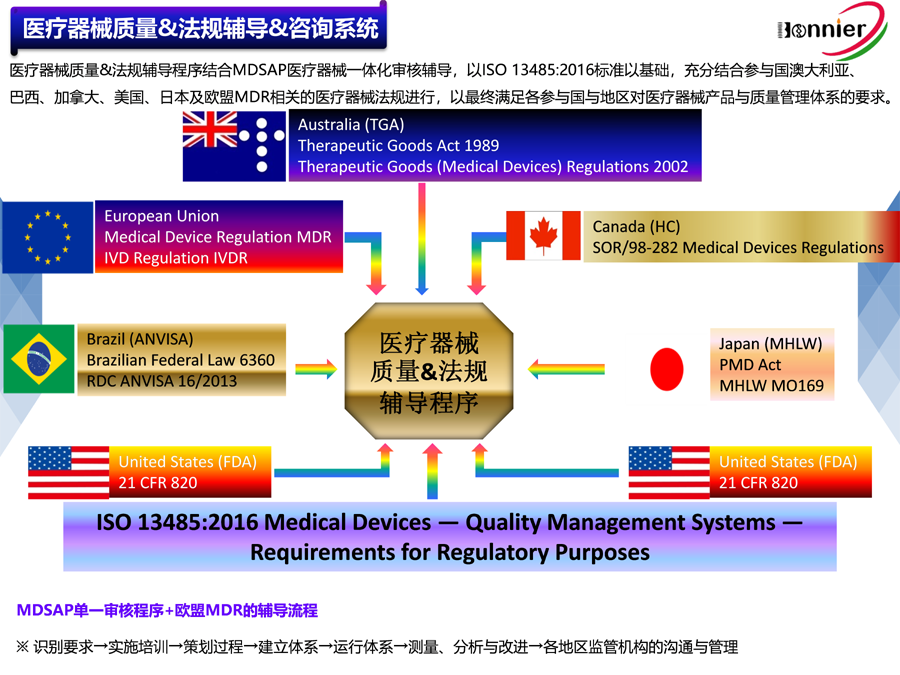
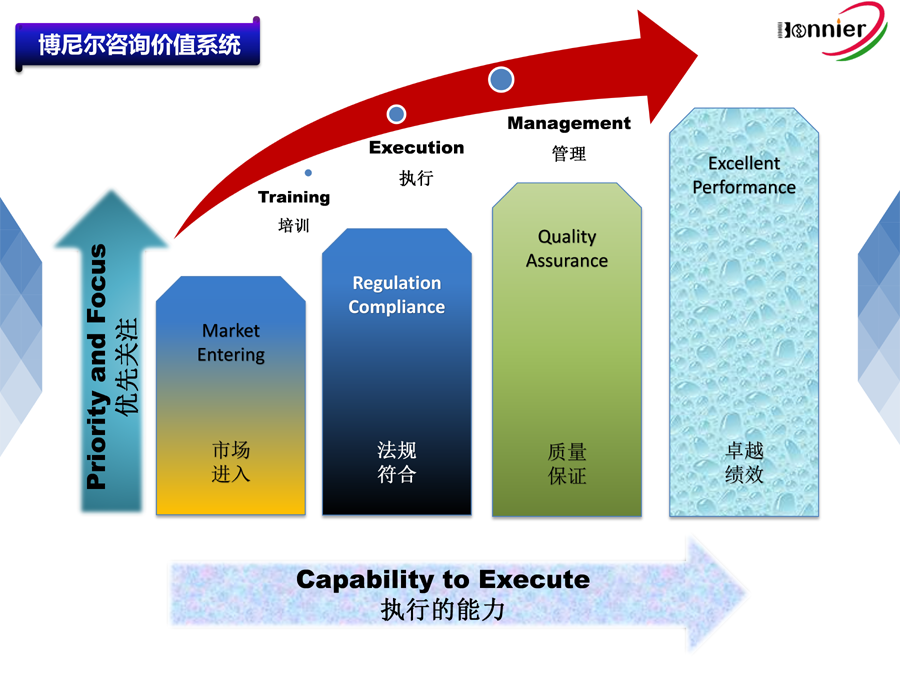
博尼尔专注的业务范围:
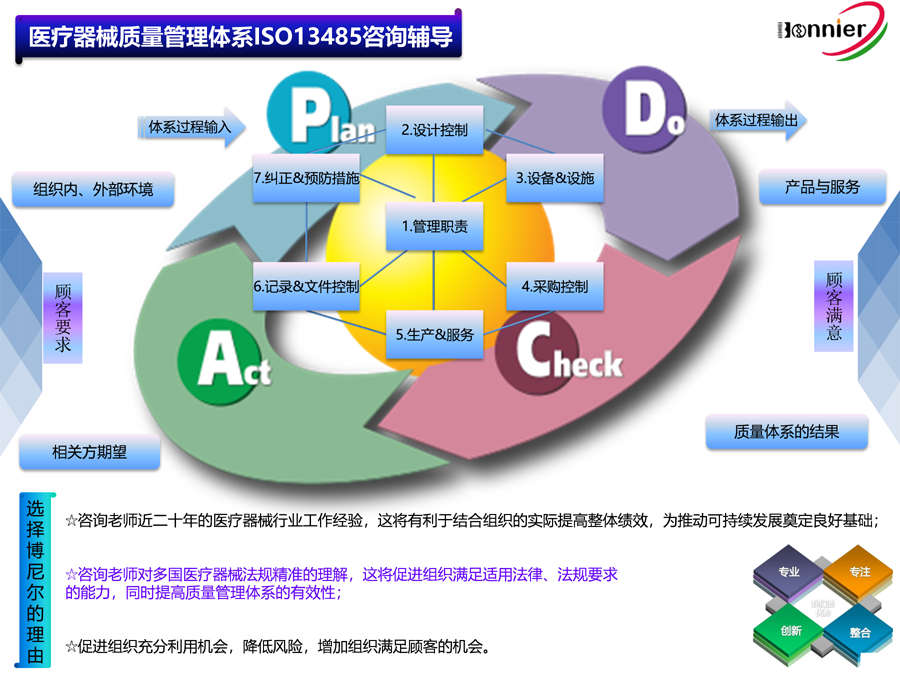
1、ISO13485医疗器械质量管理体系咨询辅导;
2、MD GMP医疗器械良好生产实践咨询辅导;
3、ISO22716化妆品GMP管理体系咨询辅导;
4、MDSAP医疗器械单一审核程序认证咨询辅导;
5、美国FDA QSR820法规体系咨询辅导、协助FDA验厂服务;
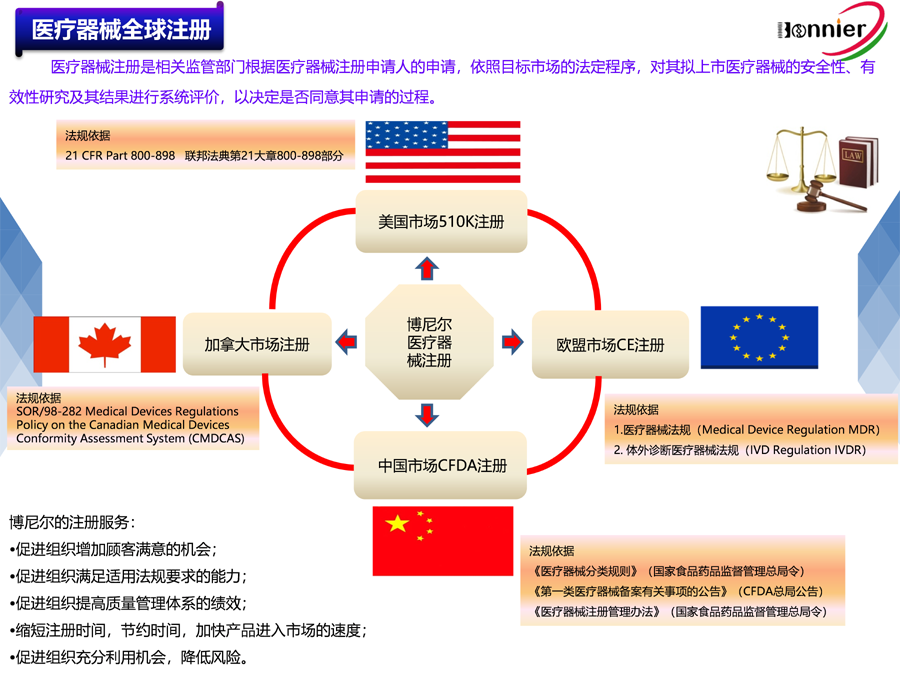
6、医疗器械全球注册服务,包括美国510k注册, 欧盟CE注册, 加拿大MDL注册及中国CFDA注册等;
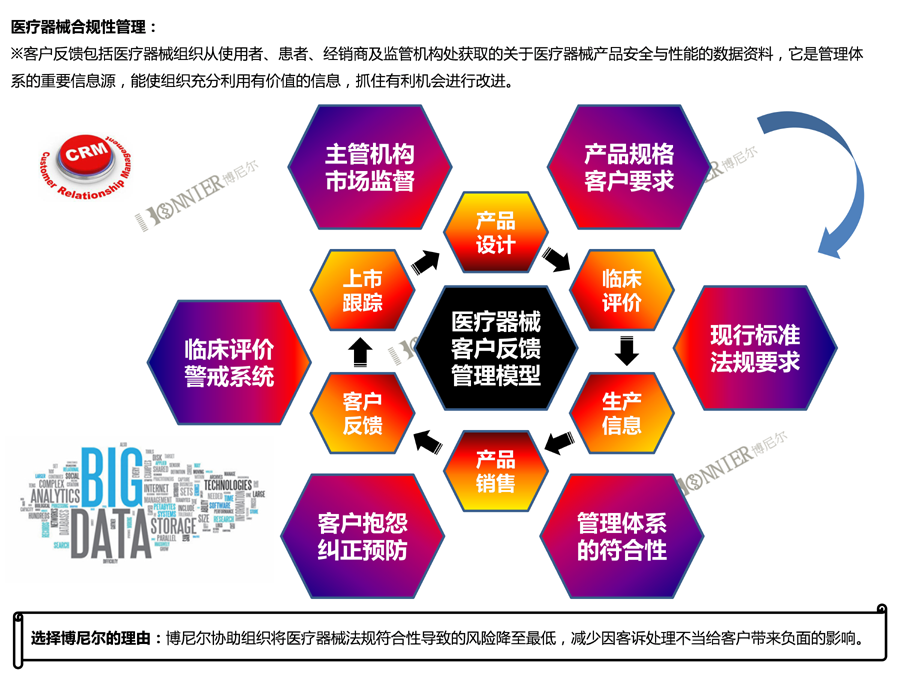
7、医疗器械上市后法规符合性服务,如医疗器械不良事件管理、医疗器械上市后跟踪服务等;
8、医疗器械法规与质量工具的培训,包括MDSAP法规、CAPA系统、验证&确认、风险管理等;
9、医疗器械中国代理人(MD delegate in China)服务为海外医疗器械生产企业提供ⅠⅡⅢ类医疗器械在中国的注册及法规符合性服务。