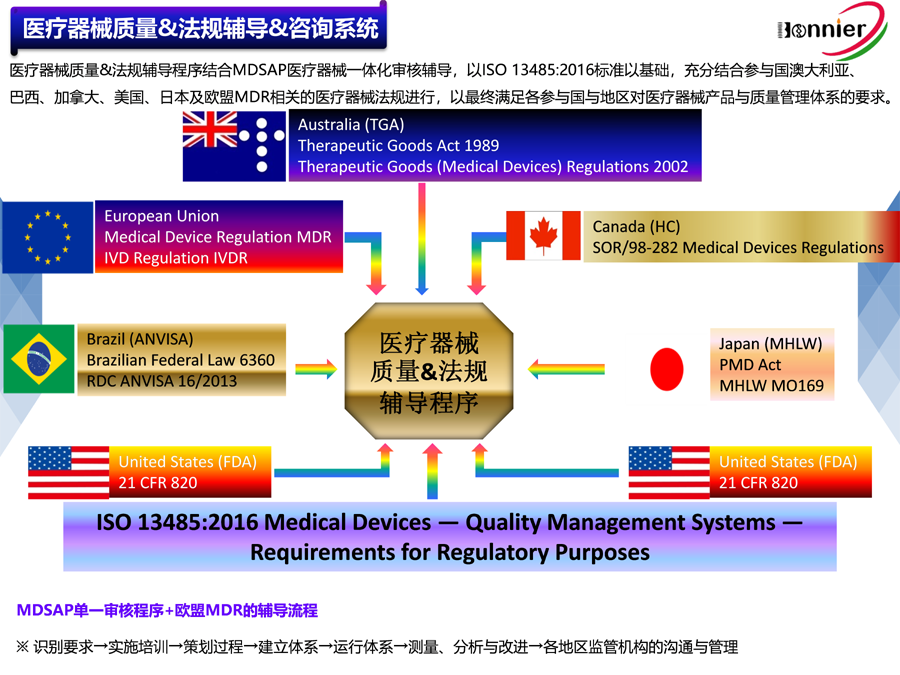
随着计算机技术的不断发展,目前在许多组织的质量管理体系中,应用计算机系统来实现质量管理体系的部分过程控制甚至全过程控制已经比较普遍。最典型的应用如文件和记录控制、库存管理以及销售管理等ERP系统。在2003版的ISO13485质量标准中,并没有提出对计算机网络系统如何应用的要求,以至于许多组织直接将很多外来软件直接装入组织的局域网运行,给组织的质量管理体系带来较大的安全和运行隐患。本文就应用于中小组织的计算机软件系统的需求、软硬件匹配和如何进行确认做一简单探讨。
一、软件需求(SR)
应用于中小组织的计算机系统最主要的要求是安全和有效。因此,在应用前对需求进行了解和对系统进行完善的策划变得尤为重要。
应用于组织的计算机系统软件包括网络操作系统软件和质量管理应用软件。操作系统软件常用的是普通Windows、Windows Serer、Linux、Unix等系统。基于安全性考虑,由于普通Windows软件不具备安全性,因此只能将其应用于大多数使用终端。Unix网络操作系统软件组网过于复杂,一般只应用于银行和安全领域,其对应的硬件价格相对昂贵。因此,对于中小组织来说,使用Windows Server和Linux作为服务器端的网络操作系统软件较为适宜。
如果选用Windows Server 服务器,则宜采用带活动目录的域管理的模式。在安全性上,Windows Server网络操作系统能满足中等强度的非法攻击和阻止非法登录。Linux操作系统较为复杂,兼容性差,对管理员要求更高,因此应用于更专业及对安全性更高的领域或组织。
对于应用软件来说,主要的要求就是软件能实现ISO 13485要求的全部或部分控制功能如文件分发、文件作废保留、实时进行记录填写(包括自动填制)并防止非授权更改和删除等。还应注意软件的兼容性,如是否能安装在网络服务器端。除此之外,还应能完成对所实现的操作过程的追踪、重现等监管(审核)功能。如果监管人员或审核人员要求演示审批流程,软件应能够实现。为了完成软件的验证,还应考虑软件具有模拟功能。
二、硬件需求
目前中小组织大多数仍采用交换机联通的有线局域网运行,有的在终端接入无线路由器(实际作用为子无线交换机)的模式。拓扑结构大多采取对等网的拓扑结构,这种对等网拓扑结构基本上无任何安全性。为了保证数据的安全,对于应用于质量体系的软件,宜采用服务器客户端模式。
对于核心硬件,应选用知名品牌的专用网络服务器,这些服务器采用专用多核心、多CPU和带有纠错功能的服务器专用存储器,进一步提高了系统稳定性,防止系统意外崩溃。而磁盘,根据组织的资金实力考虑选择Raid 0或Raid 5等磁盘阵列。如果组织需要将系统连接到互联网以便实现远程操作,则组织应根据实际能力考虑安装软件或硬件防火墙。
其他客户端,选用普通PC机并选用普通Windows操作系统即可,由于服务器带有域管理,客户端只能登陆到安全性高的服务器。
典型的硬件组合模式是:
Internet、路由器、防火墙、Server、交换器、客户端。
同时该系统还应考虑使用不间断电源(UPS)、空调机房以及其他防尘措施。如果对系统安全要求高,还要考虑封闭USB等外部端口等。
三、 应用于质量管理体系的计算机系统的确认
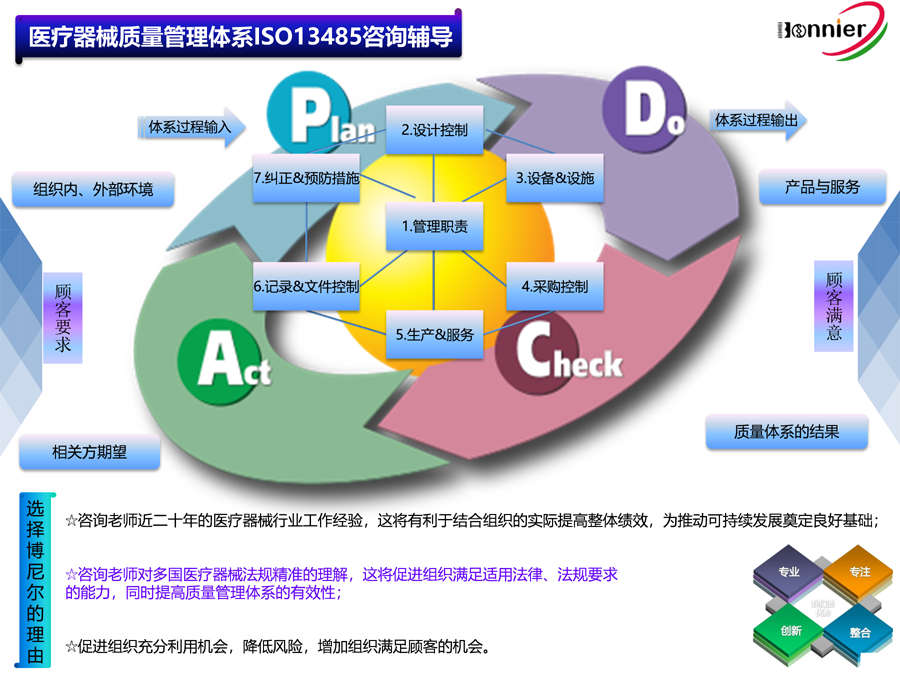
2016版ISO 13485质量管理体系的第4.1.6节明确要求“组织应将用于质量管理体系的计算机软件应用的确认程序形成文件。在软件首次使用前应对软件应用进行确认,适当时,软件或其应用更改后也应对软件应用进行确认;与软件确认和再确认有关的特定方法和活动应与软件使用有关的风险相适应;应保留这些活动的记录”。这一要求既给应用的组织提出了要求,也给监管机构和审核组织提供了审核依据。
首先,组织应明确软件需求和要求,找出应用的风险点,并针对软件和硬件以及质量体系的接口组成相关的设计和确认小组,详细描述如何将质量体系和计算机软硬件要求相结合。
其次,建立对应用于质量管理体系进行确认的文件要求和方法。计算机系统的确认和其他确认活动基本一致,需要进行安装鉴定(IQ)、操作鉴定(OQ)和性能鉴定(PQ)。应提前制定具体的确认方案。
安装鉴定(IQ)应围绕预先编制的软硬件需求和要求进行逐一核查,如适用的网络操作系统、应用软件需求和实际是否一致;相关人员(包括系统管理员及终端操作员)是否具有网络认证的操作证书及应用软件的培训证书;各网络点软件连接是否准确可靠、软件版本和硬件的规格与策划是否一致。各相关外设如UPS能否正常工作等。
操作鉴定(OQ)应围绕局域网操作系统如Windows Server、操作软件、给予相关人员权限以及各相关外设等进行实际操作,如文件试发放、作废、记录的填制等。如软件具备模拟功能,则可输入相关数据模拟运行。此外,还应模拟实际情况,允许不相关的员工进行高强度的破坏性测试,以便确认计算机系统的软硬件安全、性能等。此阶段主要考核软硬件的匹配,计算机系统安全性,软件功能实现程度以及计算机网络管控人员、各相关权限操作人员的熟练程度。
性能鉴定(PQ)应将实际运行数据由终端操作人员逐一输入计算机系统,并根据组织质量管理体系日常运行的情况实际开始试运行。在此阶段,应注意保持非计算机管理手段的并行运行,防止计算机系统发生故障崩溃后数据丢失。
在运行一段时间后(该时间可依据所选取的计算机系统的能力,如果所选取的计算机系统软硬件是否由丰富经验的大集成商完成,则时间可选择较短,反之较长),组织应将本次确认活动进行总结,编制确认报告,提出改进方案并予以追踪。
确认活动结束后,该计算机系统即可单独参与质量体系的运行了。
四、计算机系统再确认
如果计算机系统软硬件有改动,包括软硬件升级更新,以及软件重要操作人员(如系统管理员及高级权限者)有重大变动,则应考虑进行再确认。再确认需注意变动部分的安全性和可靠性,以及是否有系统漏洞。再确认的要求应在形成的文件中予以规定。
五、其他
即便计算机系统运行正常,由于法规及监管系统的要求,组织宜考虑定期对运行的文件、记录等进行备份,备份分软件备份和打印备份。
由于计算机系统的脆弱性,组织应关注系统的安全,定期对进入系统的数据、人员、用户权限和口令进行检查和监控。
医疗器械还应关注新实施的法规要求,当有新的法规出现时,应及时将相关信息传递给网络系统人员或核对软硬件需求,如果需要变更时,则应及时采取相关的措施。
总结:计算机系统确认的核心是模拟正常应用,检查系统是否能够正常运行;识别容易出错的风险点,确认是否有充分的控制方法和处理手段。
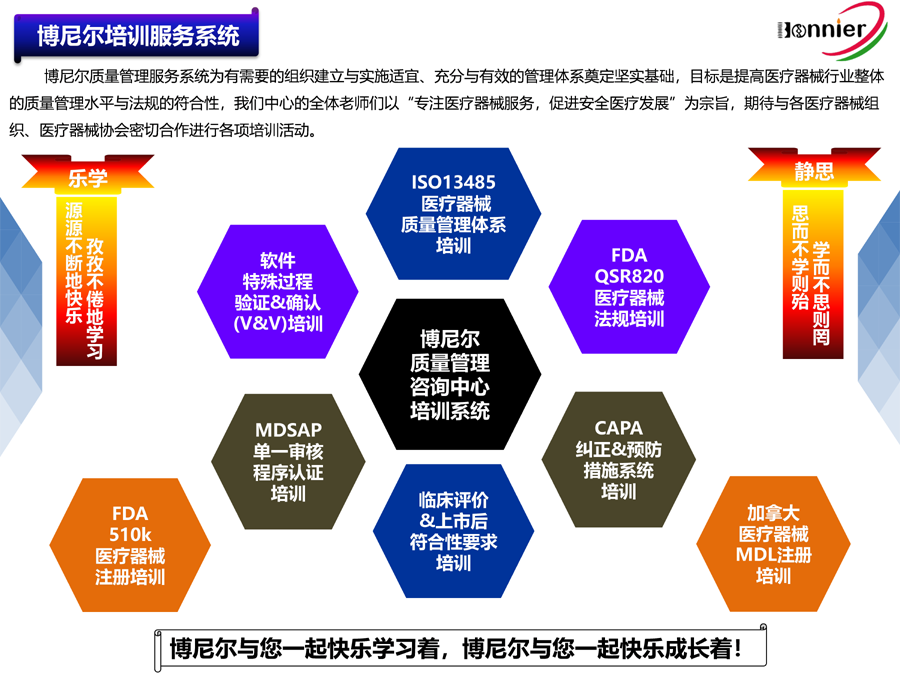
博尼尔的业务范围
1、医疗器械质量管理体系ISO13485认证咨询与辅导;
2、MDSAP医疗器械单一审核程序认证咨询与辅导;
3、美国FDA QSR820法规体系咨询与FDA验厂服务;
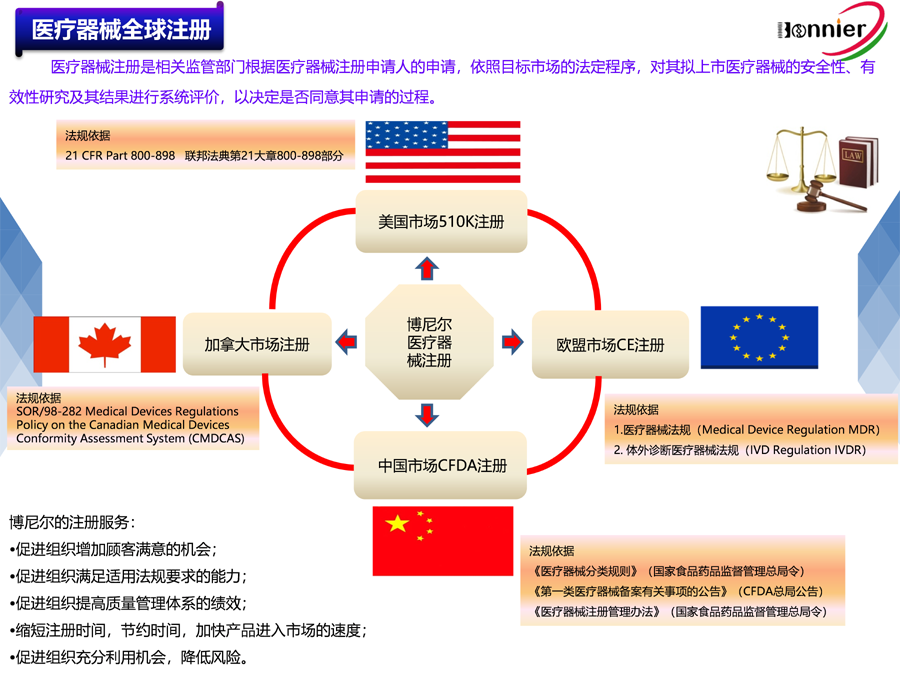
4、全球医疗器械注册代理(美国510k注册、欧盟CE注册、加拿大MDL注册及中国CFDA注册);
5、医疗器械上市后法规符合性服务(医疗器械不良事件理、医疗器械临床评价及定期安全与性能报告);
6、相关的医疗器械法规与质量工具的培训。