1.体外诊断试剂上市前需要注册检验吗?
答:申请第二类、第三类体外诊断试剂注册,应当进行注册检验。注册检验样品的生产应当符合医疗器械质量管理体系的相关要求,注册检验合格的方可进行临床试验或者申请注册。第一类体外诊断试剂办理备案时,可以提交产品自检报告。
2.体外诊断试剂批准上市前需做临床试验吗?
答:办理第一类体外诊断试剂备案,不需进行临床试验。申请第二类、第三类体外诊断试剂注册,应当进行临床试验。
有下列情形之一的,可以免于进行临床试验:
(一)反应原理明确、设计定型、生产工艺成熟,已上市的同品种体外诊断试剂临床应用多年且无严重不良事件记录,不改变常规用途,申请人能够提供与已上市产品等效性评价数据的;
(二)通过对涵盖预期用途及干扰因素的临床样本的评价能够证明该体外诊断试剂安全、有效的。
免于进行临床试验的体外诊断试剂目录由国家食品药品监督管理总局制定、调整并公布。
3.体外诊断试剂产品的预期用途指什么?
答:体外诊断试剂产品的预期用途一般是经过食品药品监督管理部门批准的,有其科学性和法定性,如“辅助诊断”与“诊断”、“早期诊断”、“筛查”、“治疗监测”、“个体化用药”(伴随诊断)等,同时在说明书上应标示定量检测或是定性检测,样本类型有何要求等。产品预期用途必须与该产品注册或备案证明文件中的相应内容相一致,不得随意夸大或变更。消费者在购买前应仔细查看产品的预期用途、注意事项等内容,咨询医生或专业人士以明确该产品是否适用。
4.消费者自用的体外诊断试剂有何特殊要求?
答:由消费者个人自行使用的体外诊断试剂,在临床试验时,应当包含无医学背景的消费者对产品说明书认知能力的评价。
5.体外诊断试剂产品都有有效期吗?
答:体外诊断试剂产品都是有有效期的。体外诊断试剂产品的有效期,是指在规定的贮存条件下才能达到的有效期,在产品标签上有明确标示;产品应在有效期内使用。
6.体外诊断试剂都是液体吗?
答:体外诊断试剂主要用于人体样本的体外检测,包括试剂、试剂盒、校准品、质控品等产品。体外诊断试剂不都是液体,也有检测试纸等其他表现形式。
7.体外诊断试剂的安全性主要体现在哪些方面?
答:体外诊断试剂是用来诊断患者或被检人员是否含有某种传染因子或机体某种功能是否正常,故试剂本身需要安全无传染性。为保证使用体外诊断试剂时人员免受阳性物质感染,所有含传染因子的材料需经灭活处理,方可使用。为保证操作人员免受损伤,试剂盒各组分的容器应避免使用玻璃材料,尽量使用塑料制品,亦避免使用金属铝盖,改用塑料材料。在化学试剂组分中,避免使用强酸,强碱试剂等。
8.怎样判断体外诊断试剂的技术性能?
答:体外诊断试剂的性能主要体现在三个方面:1、分析性能:主要包括精密度、准确度、灵敏度、特异性、线性范围或测定范围等项目,体现在产品说明书中某些技术指标可能存在不完全一致的情况。2、诊断性能:对被检测物质的敏感性与特异性程度。3、稳定性:产品的生产日期、失效期、有效期,以及校准要求等。
试剂所用的原材料与工艺,应当有明确的质量要求,并且是经过验证的,最终产品的性能符合临床使用要求。
影响产品性能的主要因素有原材料、工艺及反应体系的建立、性能评估方式方法、企业内部参考品的确立、临床评价等。
9.体外诊断试剂的贮存有哪些特殊要求?
答:体外诊断试剂的贮存比较特殊,需要一定的条件才能做到。应根据体外诊断试剂的品种、性能,实行产品分区、分类存放管理。产品贮存仓库应满足温湿度、防尘、通风、避光、贮存期限规定等要求,应设有温湿度监视与控制设施或设备,并保持监控纪录。大部分体外诊断试剂是需要在2-8℃间低温冷藏保存,少数品种需冷冻保存,也有部分品种常温保存即可。具体要求在产品说明书中均有明确标示。
10.体外诊断试剂的运输有特殊要求吗?
答:体外诊断试剂的运输过程中应满足运输条件、产品包装的规定要求。产品说明书和标签标示要求低温、冷藏的,应当按照有关规定,使用低温、冷藏设施设备运输和贮存。
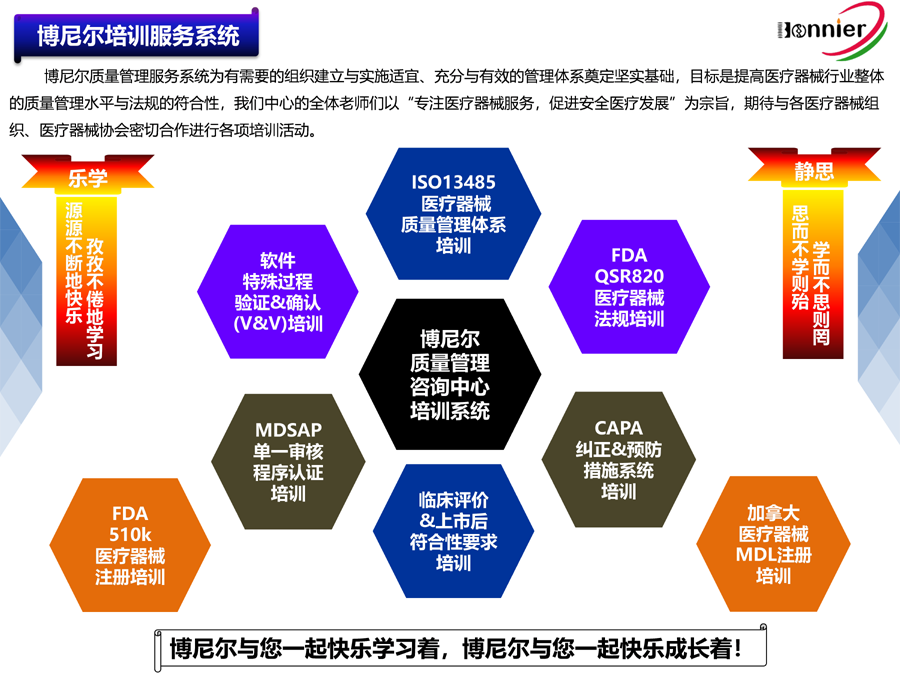
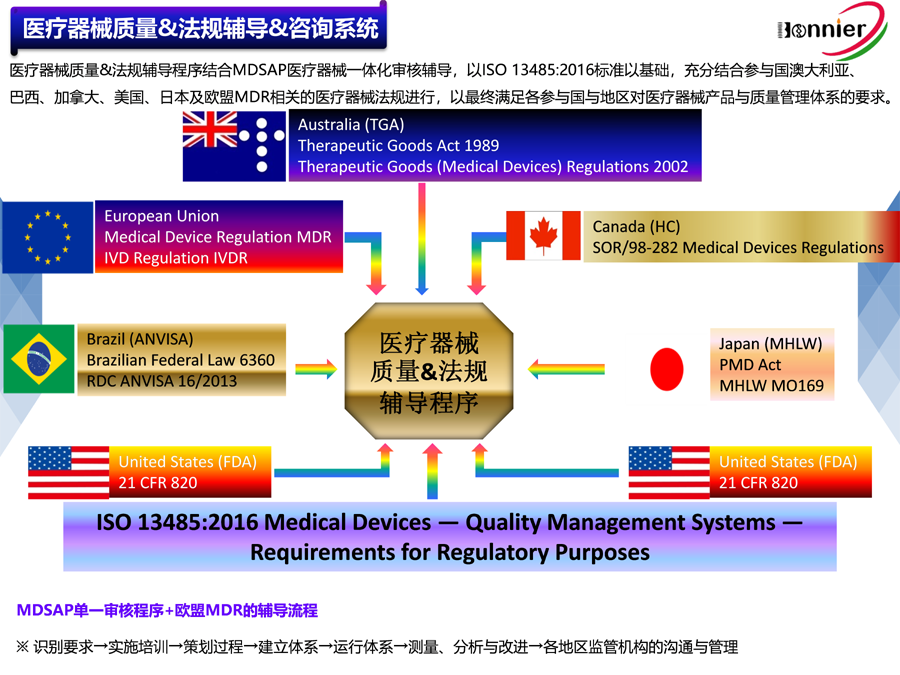
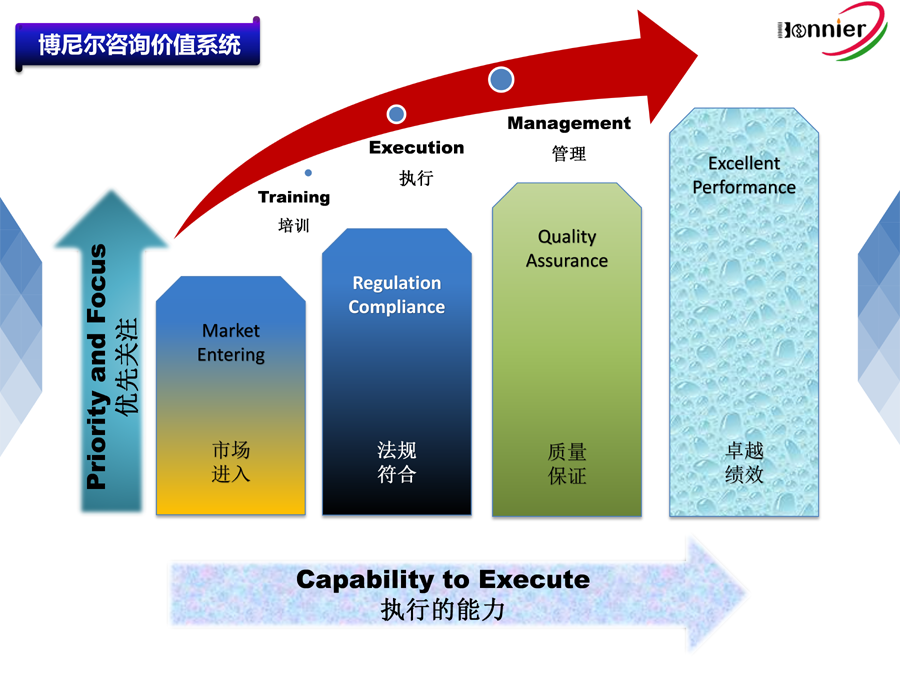
博尼尔专注的业务范围:
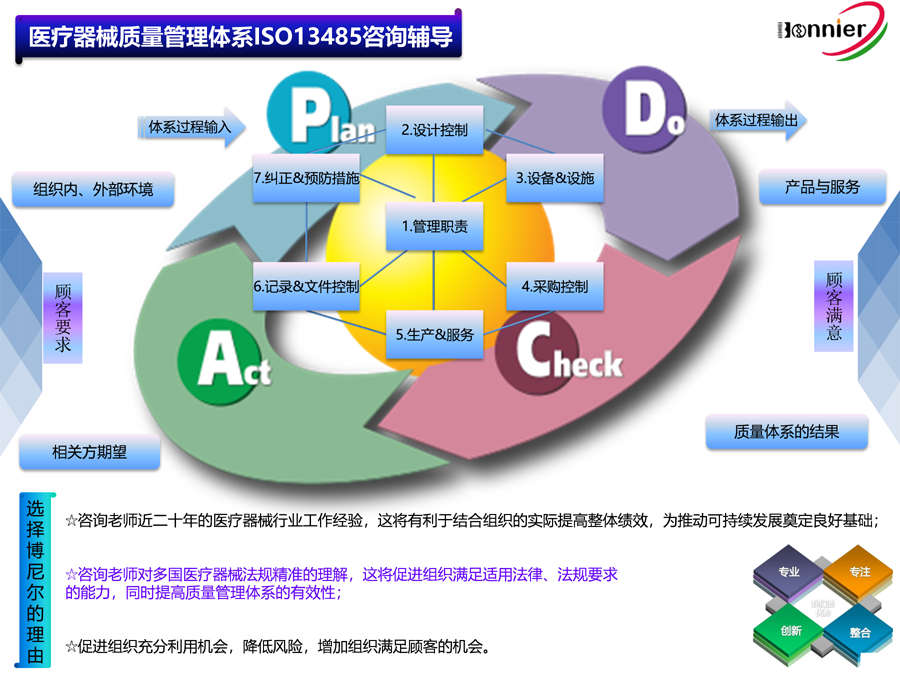
1、ISO13485医疗器械质量管理体系咨询辅导;
2、MD GMP医疗器械良好生产实践咨询辅导;
3、ISO22716化妆品GMP管理体系咨询辅导;
4、MDSAP医疗器械单一审核程序认证咨询辅导;
5、美国FDA QSR820法规体系咨询辅导、协助FDA验厂服务;
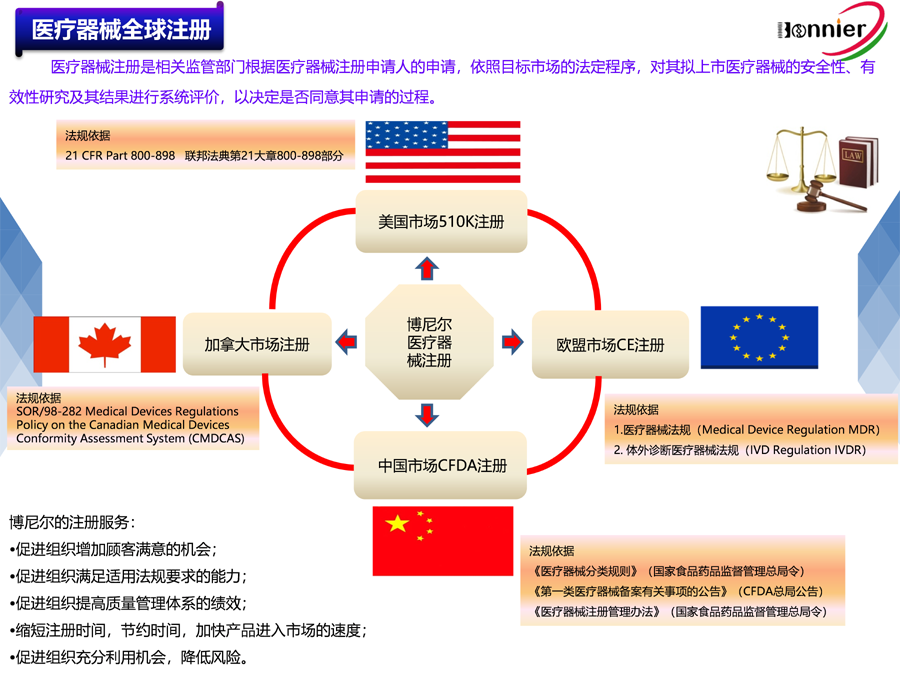
6、医疗器械全球注册服务,包括美国510k注册, 欧盟CE注册, 加拿大MDL注册及中国CFDA注册等;
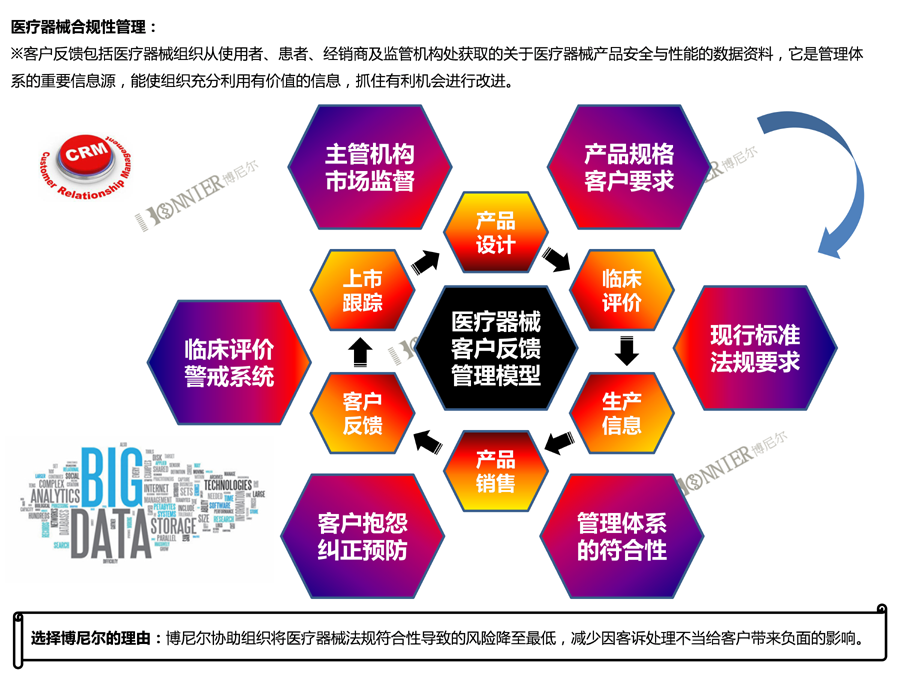
7、医疗器械上市后法规符合性服务,如医疗器械不良事件管理、医疗器械上市后跟踪服务等;
8、医疗器械法规与质量工具的培训,包括MDSAP法规、CAPA系统、验证&确认、风险管理等;
9、医疗器械中国代理人(MD delegate in China)服务为海外医疗器械生产企业提供ⅠⅡⅢ类医疗器械在中国的注册及法规符合性服务。