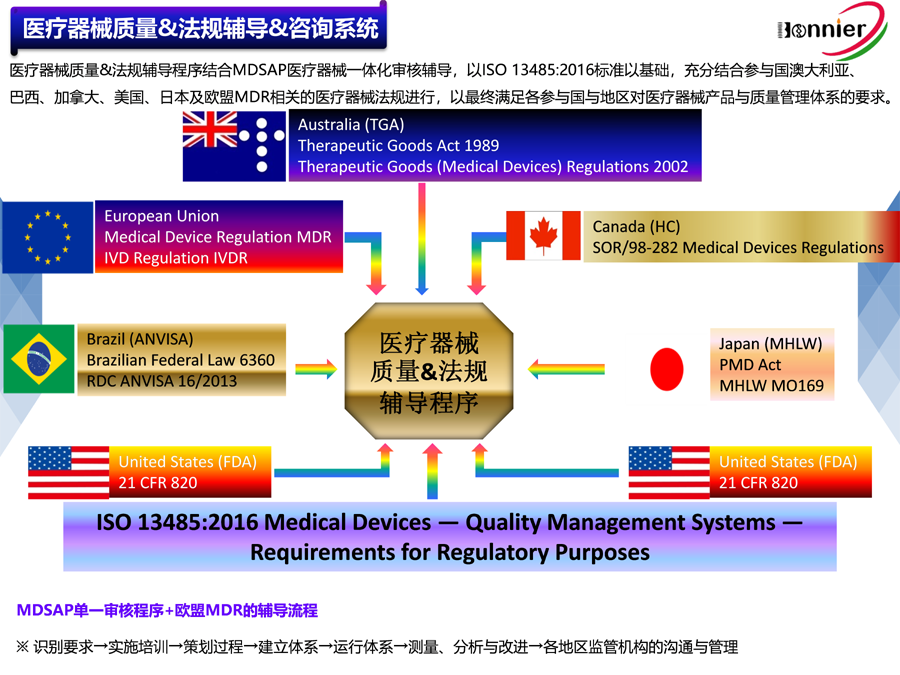
欧洲医疗器械数据库Eudamed简介
1、Eudamed目的:
(a) 帮助公众对投放于市场的器械、认证机构发出的证书及相关经济运营商有充分的了解;
(b) 实现市场上器械的唯一标识,并促进可追溯性;
(c) 帮助公众充分了解临床研究情况,并要求临床研究申办方遵守所采用的法案规定的义务;
(d) 要求制造商遵守第 87 至 90 条或任何根据第 91 条所采用法案规定的信息义务;
(e) 使成员国和委员会的主管机构能够在充分知情的基础上执行与本法规有关的 任务,并加强它们间的合作。
2、Eudamed 涉及的电子系统:
(a) 在第 29(4)条中所述器械注册电子系统;
(b) 第 28 条所指的 UDI 数据库;
(c) 在第 30 条中所述的经济运营商电子登记系统;
(d) 在第 57 条中所述的认证机构和证书电子系统;
(e) 在第 73 条中所述的临床研究电子系统;
(f) 第 92 条所指的警戒和上市后监管电子系统;
(g) 第 100 条所指的市场监管电子系统。
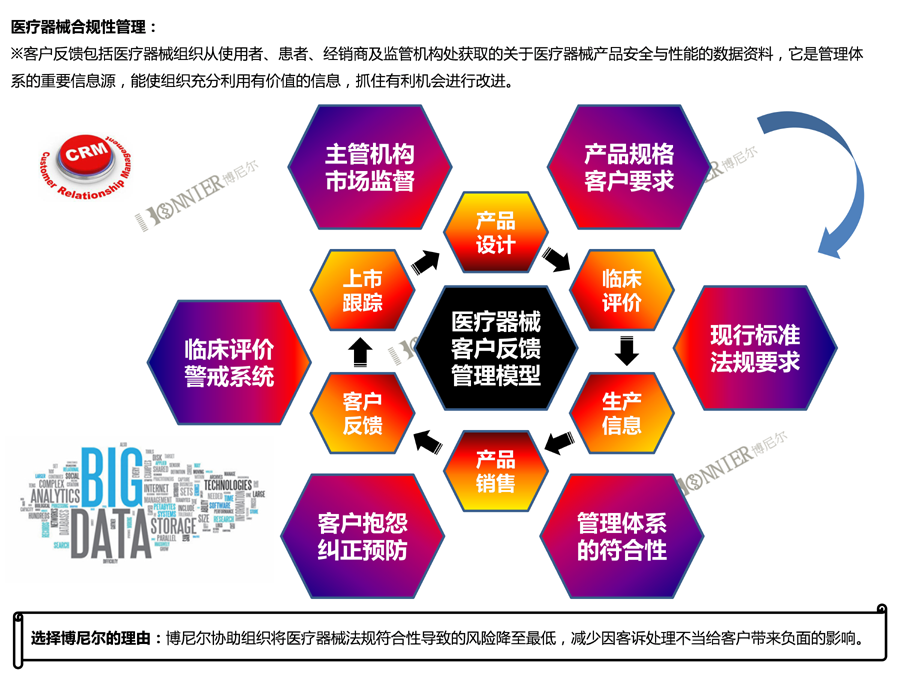
从以上子系统可以看到,MDR正式生效执行后,这些资料必须在EUDAMED里注册: 医疗器械注册经济运营商(指制造商,进口商等)信息,、器械UDI信息、CE认证证书,、临床研究信息,、警戒和上市后监管信息,、市场监管信息等.
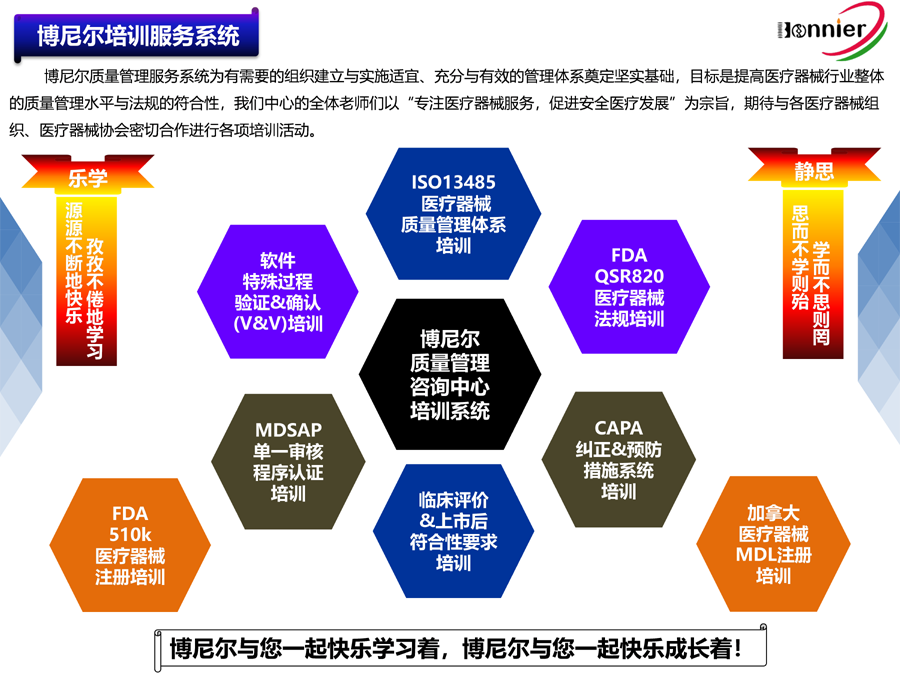
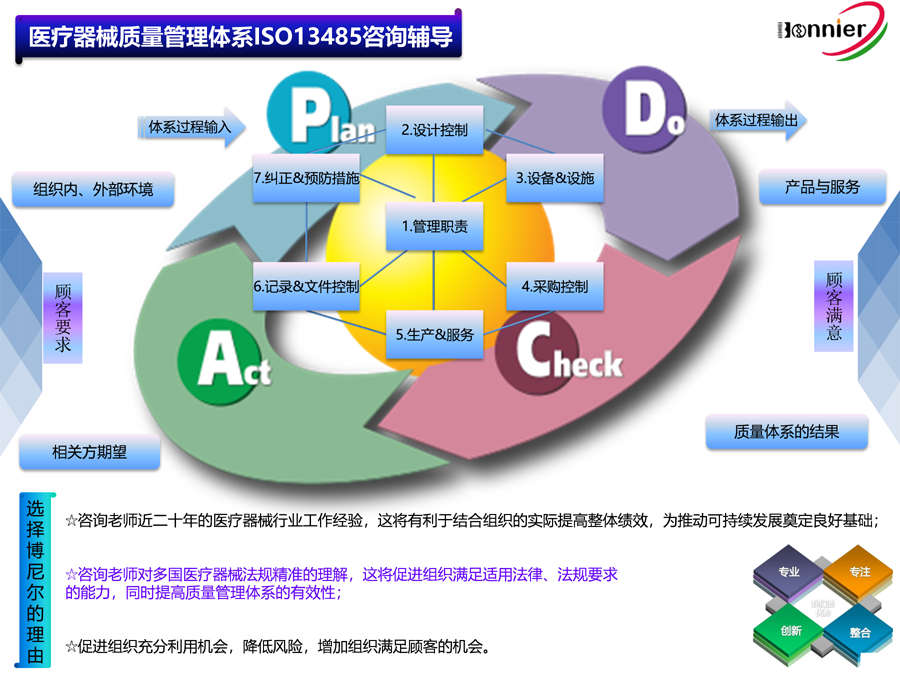
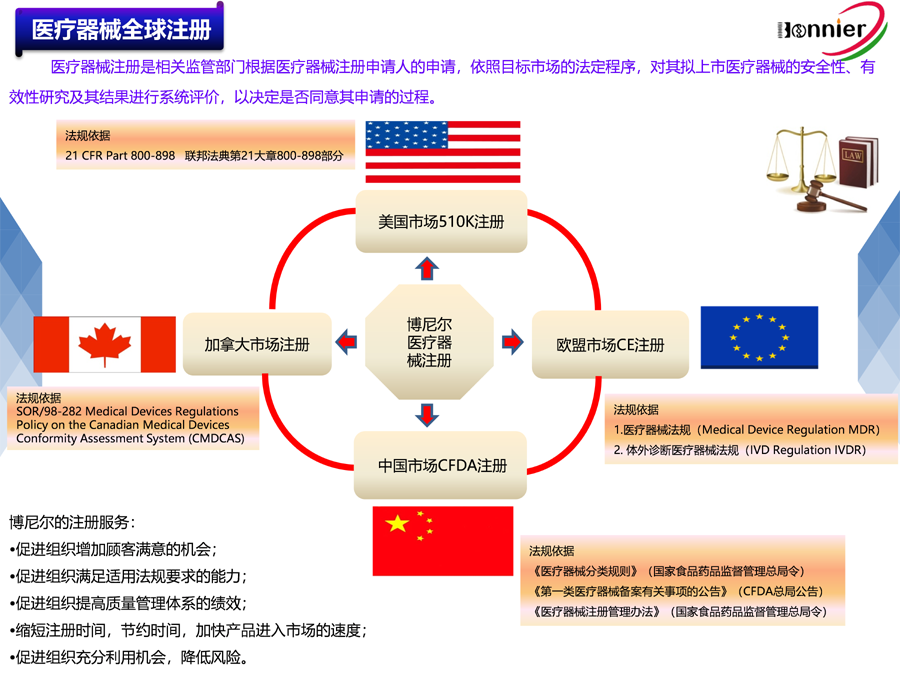
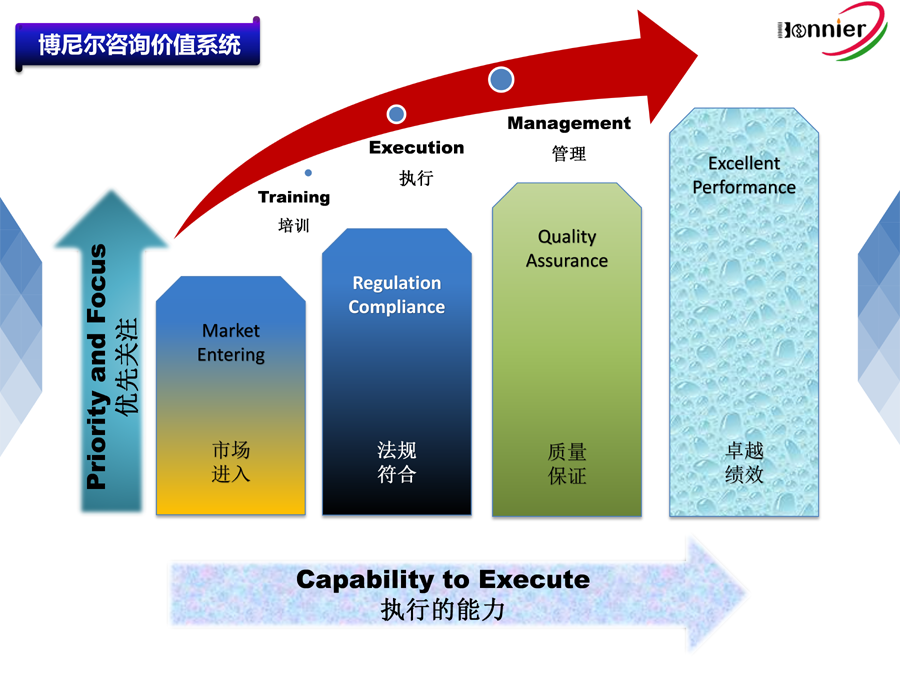
博尼尔擅长的业务范围:
※医疗器械注册咨询服务: ※医疗器械质量管理体系咨询辅导服务: ※医疗器械授权代表服务:
医疗器械FDA 510k注册服务; ISO13485认证咨询辅导服务; 医疗器械英国授权代表UKRP;
医疗器械FDA 510k认证咨询; 医疗器械MDR CE认证咨询辅导服务; 医疗器械瑞士授权代表CH REP;
医疗器械加拿大MDL注册服务; 医疗器械MDSAP认证咨询辅导服务; 医疗器械美国代理人FDA Agent;
医疗器械MDR CE注册服务。 医疗器械QSR820法规咨询辅导服务。 医疗器械欧盟授权代表EC REP。