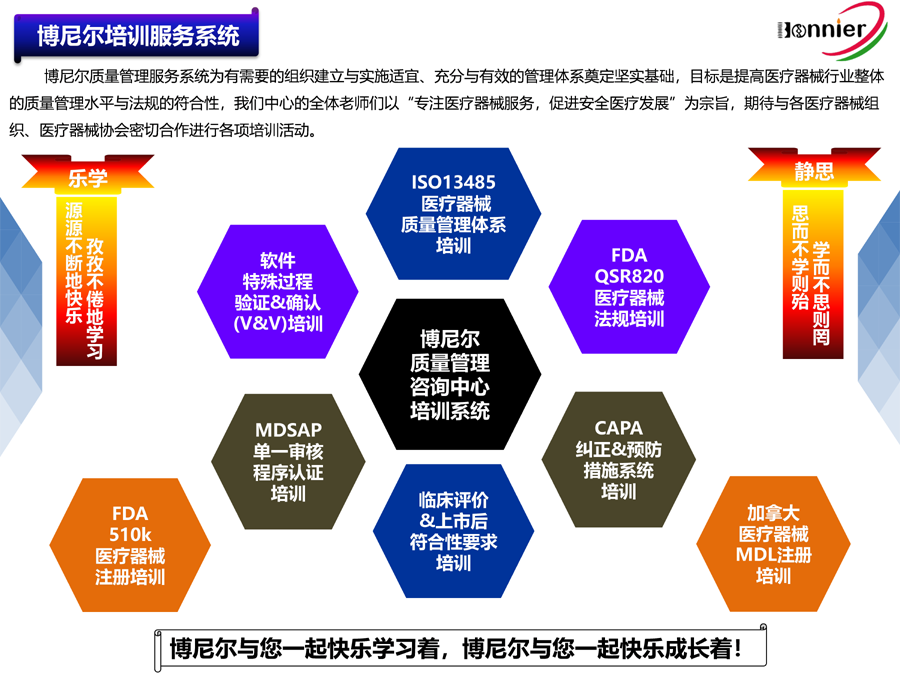
医疗器械美国510k注册咨询:
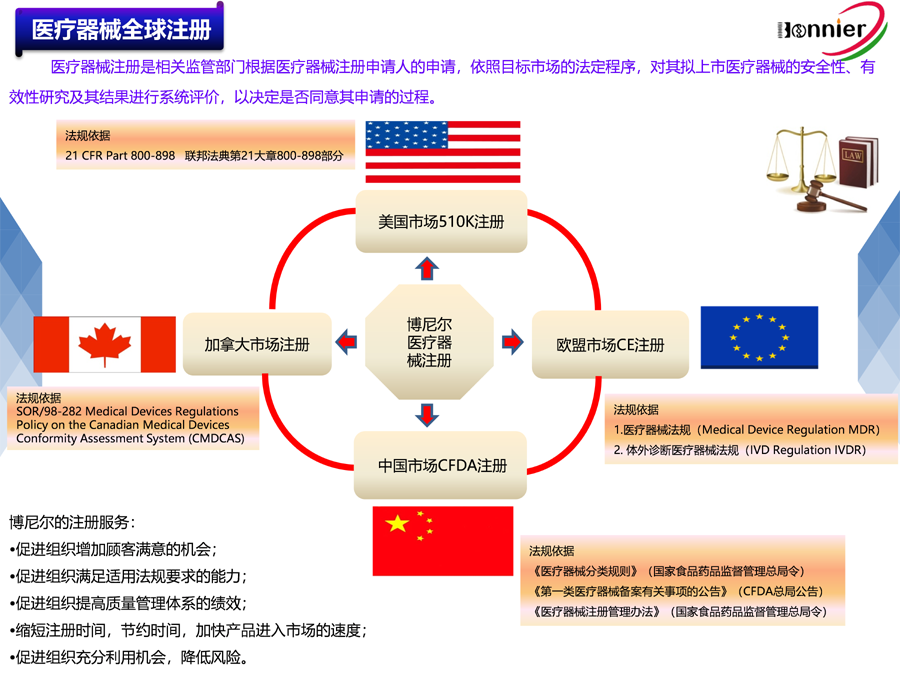
1.510k注册流程:510k(Premarket Notification)是美国FDA对II类和部分I类、III类医疗器械的上市前通告程序,旨在证明新器械与已合法上市的器械具有相同的安全性和有效性。申请者需在产品上市前90天提交510k文件,FDA将在90天内决定是否批准。
2.豁免情况:部分I类和II类产品可豁免510k要求,直接通过注册和列名进入市场。
3.费用:2024年,FDA对510k申请的费用为$21,760,小型企业费用为$5,440。
4.服务内容:包括文件准备、技术文档撰写、检测评估、FDA合规性审查等。
医疗器械欧盟CE注册咨询:
1.CE认证流程:欧盟CE认证是医疗器械进入欧洲市场的必备条件,涉及产品符合性声明或公告机构认证。企业需准备技术文件(TCF),并由欧盟授权代表协助完成注册。
2.分类与要求:欧盟将医疗器械分为四类,风险越高,注册周期越长。大部分产品可通过自我声明方式完成CE认证,但高风险产品需通过公告机构认证。
3.费用:欧盟CE认证的费用因产品类别和复杂性而异,通常在30,000至500,000欧元之间
4.服务内容:包括技术文件编写、临床评估报告、公告机构认证申请、欧盟授权代表服务等。
医疗器械PMN 510k注册咨询:
1.PMN与510k的关系:PMN即510k,是美国医疗器械上市前通告程序,适用于大多数II类和部分I类、III类医疗器械。
2.服务内容:提供510k文件准备、技术文档撰写、检测评估、FDA合规性审查等服务,帮助企业顺利通过FDA审查。
总结:
美国510k和欧盟CE注册是医疗器械进入国际市场的关键步骤。企业需根据产品类别和风险等级选择合适的注册路径,并通过专业的咨询服务机构博尼尔质量管理咨询(江门)中心确保符合相关法规要求。
博尼尔质量管理咨询(江门)中心擅长的业务范围:
※医疗器械注册咨询辅导服务
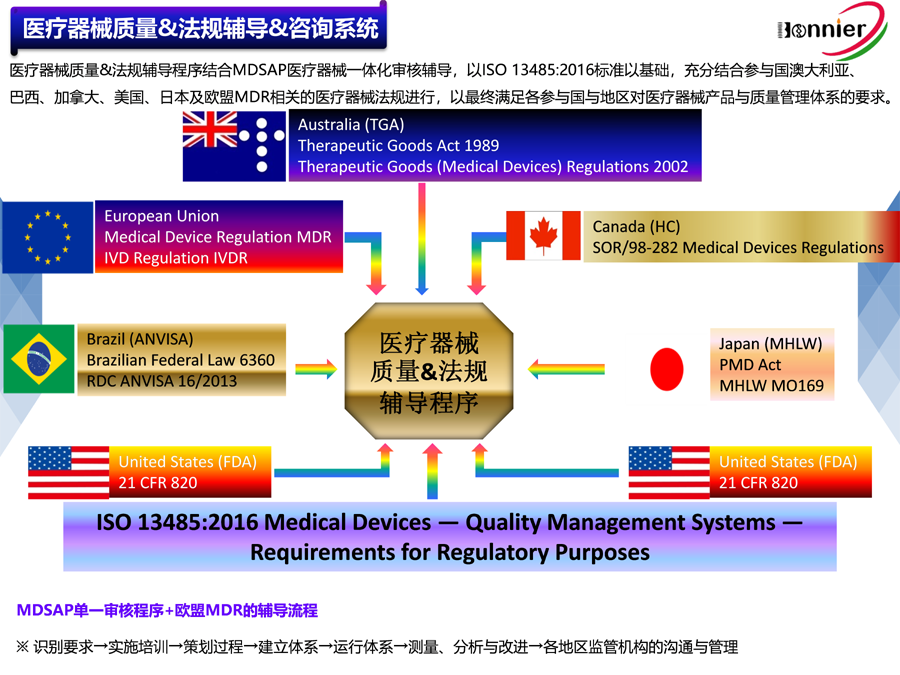
医疗器械美国FDA 510k注册咨询服务;
医疗器械加拿大HC MDL注册咨询服务;
医疗器械澳大利亚TGA注册咨询服务;
医疗器械欧盟CE注册咨询服务。
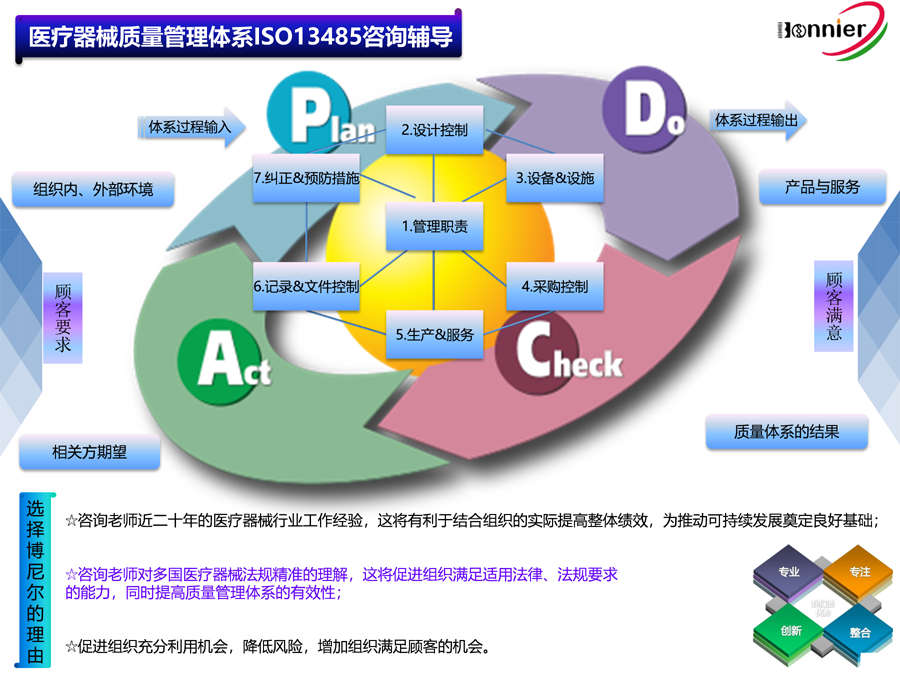
※医疗器械法规&质量管理体系咨询辅导服务:
ISO13485医疗器械质量管理体系认证咨询辅导服务;
医疗器械欧盟MDR745认证咨询辅导服务;
医疗器械欧盟IVDR746认证咨询辅导服务;
医疗器械MDSAP认证咨询服务;
医疗器械美国QSR820咨询辅导服务。
※医疗器械授权代表服务:
英国授权代表UKRP;
瑞士授权代表CH REP;
美国代理人FDA Agent;
欧盟授权代表EC REP。