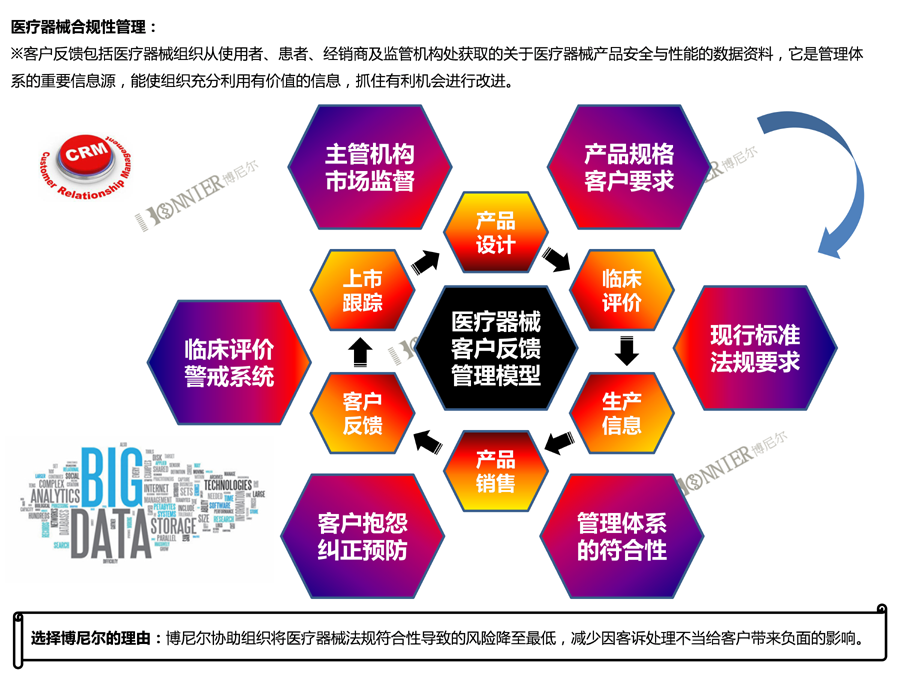
Medical Device Clinical Evaluation医疗器械临床评价是一系列持续活动,使用科学方法评估和分析临床数据,以验证医疗器械在制造商预期使用下的安全性和有效性。临床评价贯穿医疗器械的整个生命周期,首先在开发阶段进行,以识别需要生成的数据,以满足监管要求,并确定是否需要进行新的临床试验。
医疗器械临床评价是在医疗器械研发和上市过程中进行的。在这个过程中,需要对医疗器械在临床实践中的使用效果、安全性和有效性进行系统的评估和评价。通过对临床数据的收集、分析和总结,可以评估医疗器械在临床实践中的表现,并为医疗器械的研发和改进提供重要的参考和支持。
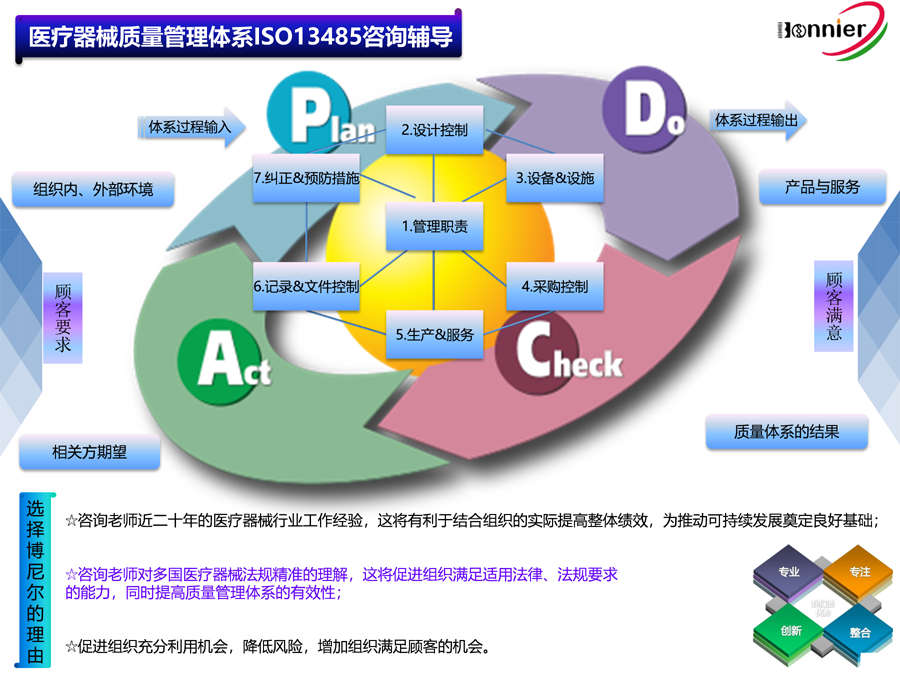
医疗器械临床评价需要采用科学的方法和程序。这些方法和程序包括对临床数据的收集和分析、对医疗器械的安全性和有效性进行评估、比较医疗器械与其他现有治疗方法的优劣等。通过这些方法和程序,可以得出准确的结论,为医疗器械的研发和改进提供重要的参考和支持。
临床评价的方式多样,包括临床试验、文献数据分析、同品种医疗器械比对和临床经验数据等。
评价路径的选择:对于低风险或中低风险的医疗器械,已有足够的科学文献、临床使用经验和同类产品的数据支持其安全性和有效性,可以通过提交现有的科学文献、临床使用数据和同类产品的数据来进行临床评价。
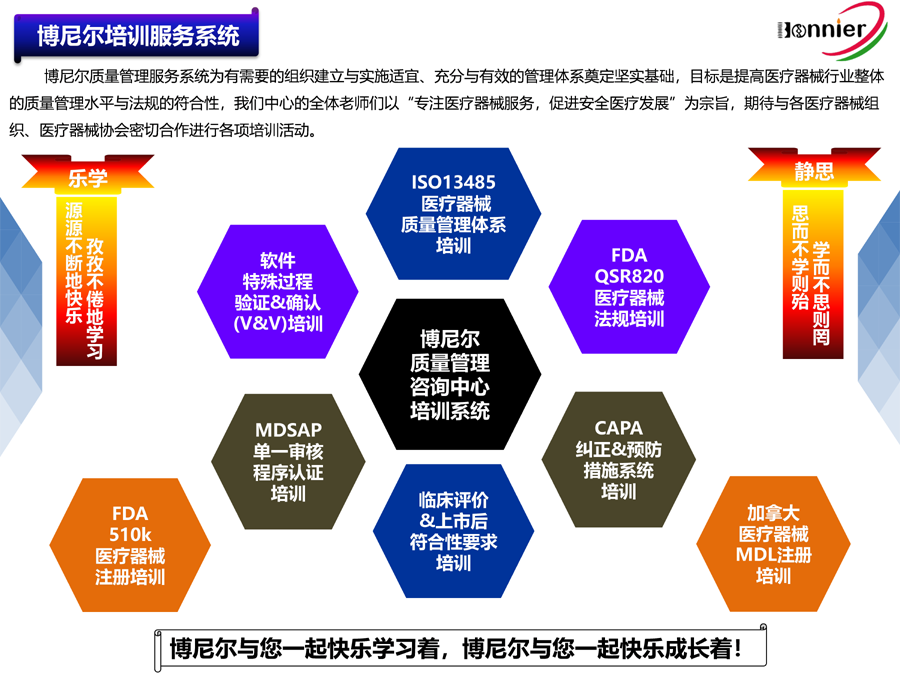
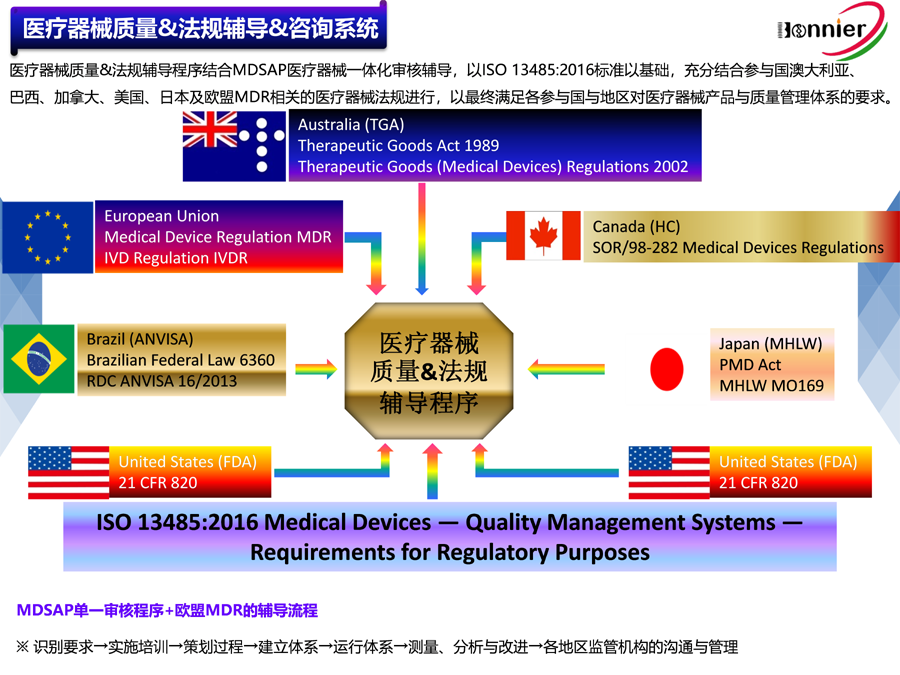
博尼尔质量管理咨询(江门)中心擅长的业务范围:
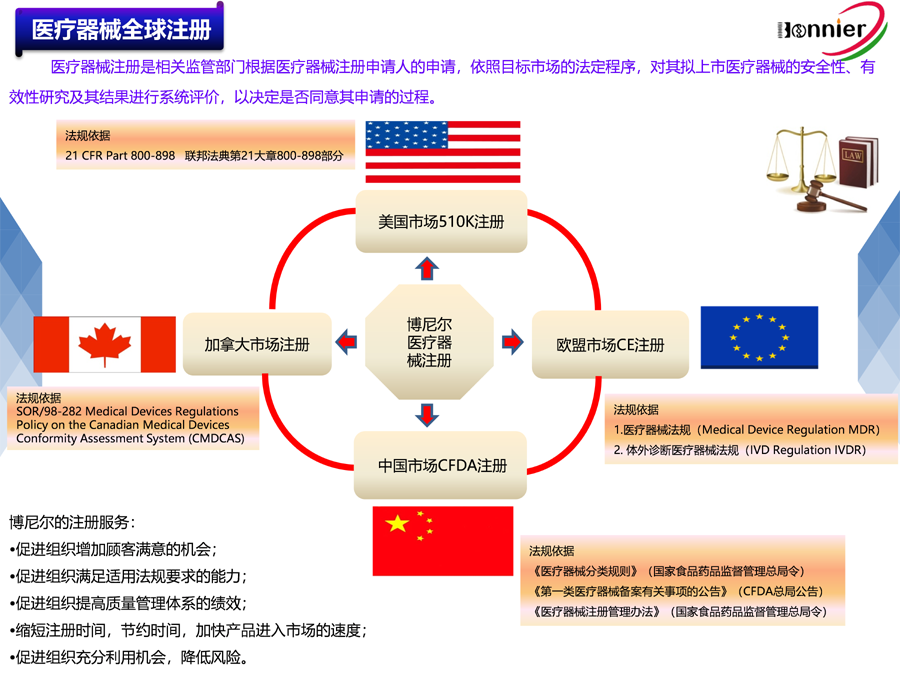
※医疗器械注册咨询辅导服务
医疗器械美国FDA 510k注册咨询服务;
医疗器械加拿大HC MDL注册咨询服务;
医疗器械澳大利亚TGA注册咨询服务;
医疗器械欧盟CE注册咨询服务。
※医疗器械法规&质量管理体系咨询辅导服务:
ISO13485医疗器械质量管理体系认证咨询辅导服务;
医疗器械欧盟MDR745认证咨询辅导服务;
医疗器械欧盟IVDR746认证咨询辅导服务;
医疗器械MDSAP认证咨询服务;
医疗器械美国QSR820咨询辅导.