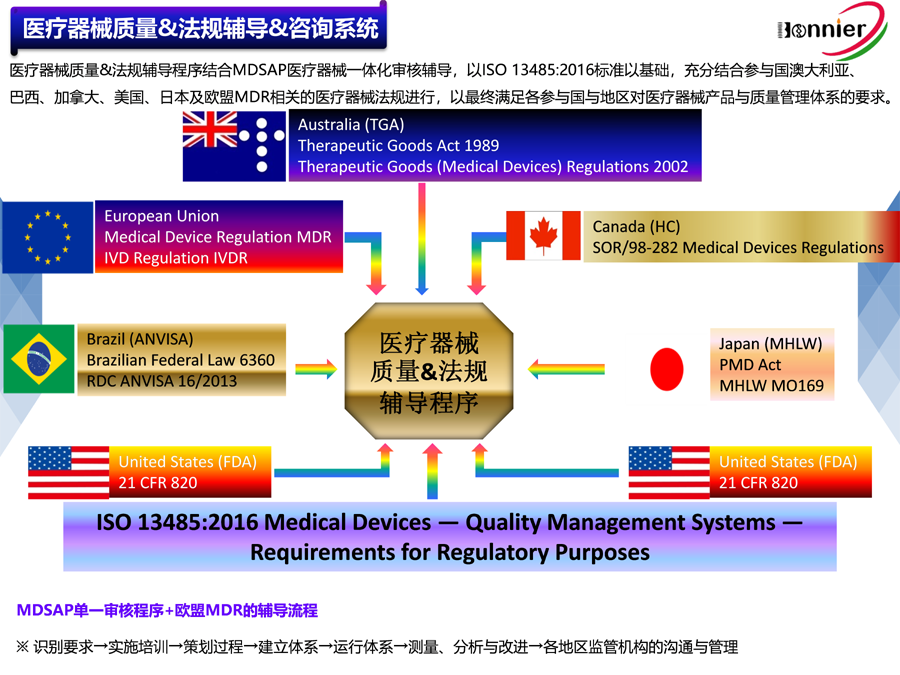
澳大利亚医疗器械的注册由治疗用品管理局(Therapeutic Goods Administration,简称TGA)负责管理,旨在确保医疗器械的安全性和有效性。以下是详细的注册流程:
1.确定产品分类:根据2002年《治疗商品(医疗器械)条例》,医疗器械被分为I类、IIa类、IIb类、III类和IV类。不同类别的医疗器械需要满足不同的注册要求和审核流程。
2.指定澳大利亚授权代表(Sponsor):非澳大利亚本地公司必须指定一个澳大利亚授权代表来完成注册工作。授权代表负责与TGA沟通、提交注册申请,并处理后续的监管事务。
3.准备技术文件:制造商需准备详细的技术文件,包括产品描述、设计验证、临床评估报告、风险管理文件等,这些文件需符合TGA的技术标准和法规要求。
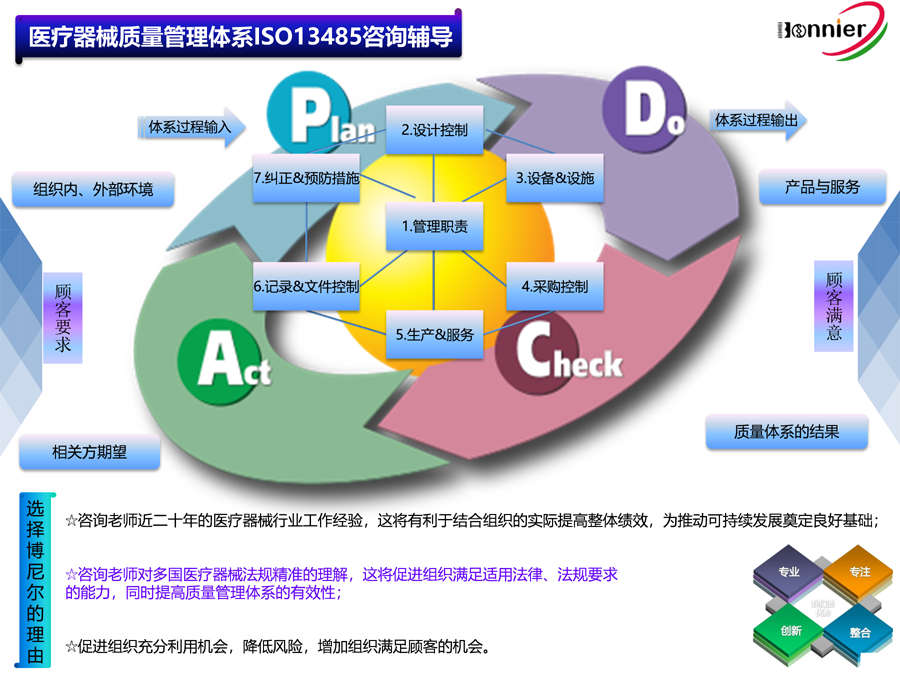
4.建立质量管理体系:制造商需确保拥有ISO13485:2016认证或MDSAP认证。
5.提交注册申请:通过TGA的电子系统(如TBS系统)提交注册申请,包括技术文件、澳大利亚合格声明等。
6.技术评估与审查:TGA将对提交的注册申请进行技术评估和审查,可能涉及书面审查、技术数据评估,高风险设备可能有现场检查。
7.生物相容性评估:对于与人体接触的医疗器械,TGA会要求进行生物相容性评估,以确保其不会对人体造成不良反应或毒性。
8.获得注册证书:如果医疗器械符合TGA的要求,TGA将颁发相应的注册证书或许可证,允许其在澳大利亚市场上销售和使用。
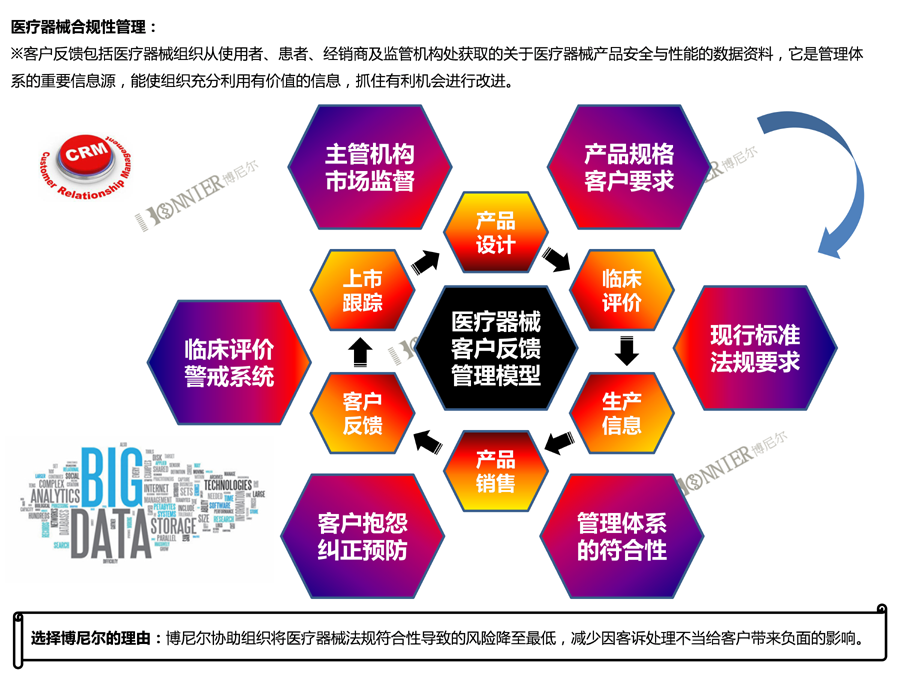
9.持续监管与合规:获得注册后,制造商需要确保持续遵守澳大利亚的相关法规和标准,接受TGA的监管和检查,包括定期更新技术文件、报告产品变更、回应TGA的要求等。
需要注意的是,澳大利亚的医疗器械注册流程可能较为复杂和耗时,通常需要几个月的时间完成审批。此外,不同类别的医疗器械所需的时间和费用也有所不同,例如I类和IIa类通常需要约4周,IIb类需要6周,III类和有源植入式医疗器械大约需要6个月。
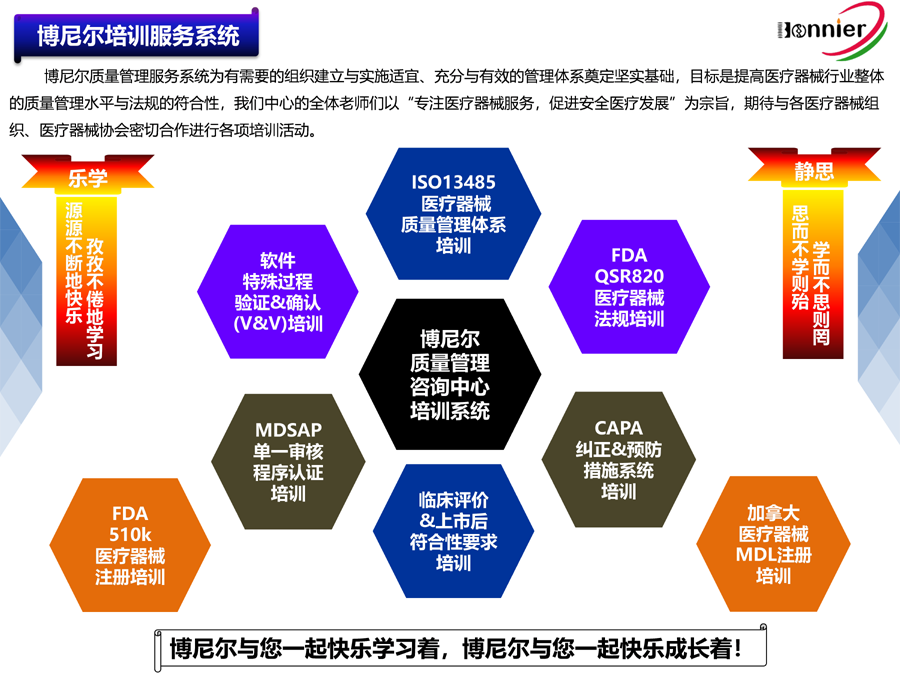
博尼尔质量管理咨询(江门)中心擅长的业务范围:
※医疗器械注册咨询辅导服务
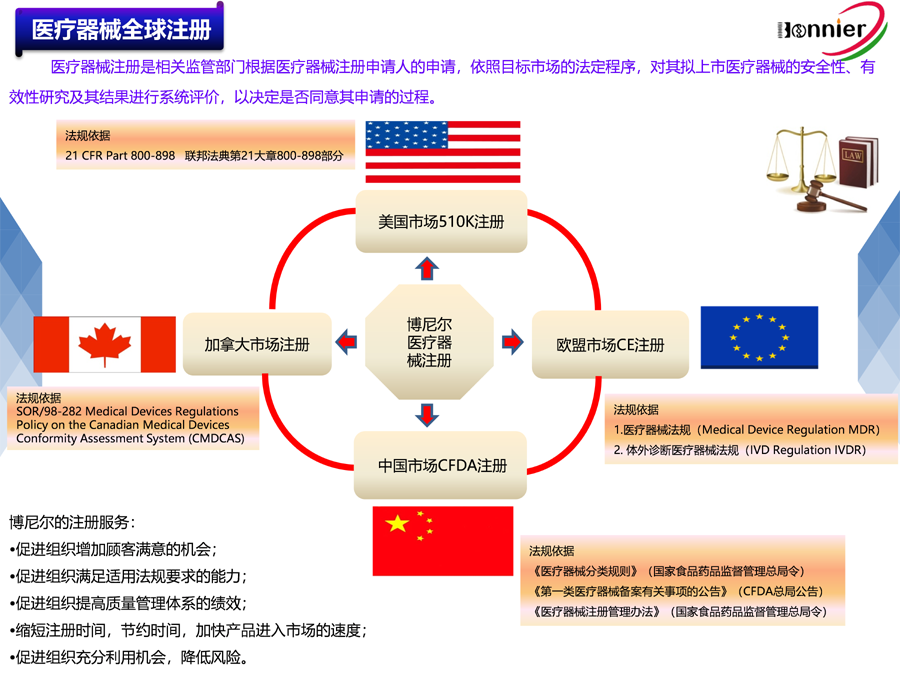
医疗器械美国FDA 510k注册咨询服务;
医疗器械加拿大HC MDL注册咨询服务;
医疗器械澳大利亚TGA注册咨询服务;
医疗器械欧盟CE注册咨询服务。
※医疗器械法规&质量管理体系咨询辅导服务:
ISO13485医疗器械质量管理体系认证咨询辅导服务;
医疗器械欧盟MDR745认证咨询辅导服务;
医疗器械欧盟IVDR746认证咨询辅导服务;
医疗器械MDSAP认证咨询服务;
医疗器械美国QSR820咨询辅导服务。
※医疗器械授权代表服务:
英国授权代表UKRP;
瑞士授权代表CH REP;
美国代理人FDA Agent;
欧盟授权代表EC REP。